| Startseite » Themen & Texte » Physikalische Chemie » Innere Energie | Zurück zur vorherigen Seite | Sitemap Impressum/Datenschutzerklärung |
![]()
Herleitung: Die Innere Energie eines Systems ist definiert als die Summe aller Energieformen des Systems. Sie ist eine Zustandsgröße.
Einige dieser Energien können für 'übliche' Prozesse als zeitlich konstant angesehen werden, z. B. die Kernenergie. In der Thermodynamik sind deshalb oftmals nur die Änderungen bezüglich der Wärmeenergie bzw. die geleistete Arbeit relevant. Die Änderung der Inneren Energie eines Systems ist demnach gleich der ihm zugeführten →Wärmemenge plus der am System geleisteten Arbeit.
![]()
Herleitung: Arbeit ist das Produkt aus Weg und Kraft in Wegrichtung (w = Fs). Der Druck ist definiert als Kraft pro Fläche (p = F:A).
Also ist F = pA (1) und w = Fs (2). Setzt man (1) in (2) ein, so erhält man w = pAs = pV (1/2), denn V ist genau das Volumen, das von der Fläche A entlang des Weges s überstrichen wird.
V kann nun durch die bei der Arbeit erzielte Volumendifferenz ersetzt werden. Für den allgemeinen Fall nicht konstanter Kraft (bzw. Druck) wird daraus dV, und man berechnet so dw.
Bei Expansion, d. h. Volumenvergrößerung, ist dV > 0 und damit auch dw > 0 (für Kontraktion gilt die Betrachtung entsprechend andersherum). Das System muß also Arbeit verrichten, um zu expandieren, es verliert also Energie. Da dadurch die →innere Energie sinken muß, führt man in (1/2) ein negatives Vorzeichen ein und erhält so die gesuchte Beziehung.
![]()
Erläuterung: Um Stoffe um eine bestimmte Temperaturdifferenz zu erwärmen, benötigt man unterschiedliche Energiemengen. Deshalb führt man die stoffspezifische Größe der 'molaren Wärmekapazität C' ein, die angibt, wieviel Energie benötigt wird, um ein Mol des Stoffes um 1 Kelvin zu erwärmen. Für andere Stoffmengen und/oder Temperaturdifferenzen ist mit den entsprechenden Werten zu multiplizieren.
Da die Wärmekapazität nur in erster Näherung temperaturunabhängig ist, darf für genauere Berechnungen über größere Temperaturbereiche die obige Formel nicht als Differenzfunktion geschieben werden, sondern muß geeignet integriert werden.
Die Wärmekapazität hängt weiterhin von den Prozeßbedingungen ab. Häufig werden in der Praxis die Werte für konstanten Druck (→Cp) oder konstantes Volumen (→CV) verwendet. Die Unterschiede sind hauptsächlich bei Gasen relevant, da diese im Gegensatz zu Festkörpern und Flüssigkeiten eine merkliche Temperaturabhängigkeit des Volumens zeigen. Die Differenz ist über einen einfachen →Zusammenhang in guter Näherung berechenbar.
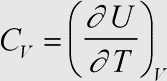
Erläuterung: Dies ist die Definition der molaren Wärmekapazität bei konstantem Volumen. Sie ist ein Faktor der Zustandsfunktion der molaren Inneren Energie (die unter isochoren Bedingungen der ausgetauschten Wärmemenge entspricht) und beschreibt das Maß der Änderung der molaren Inneren Energie mit der Temperatur.
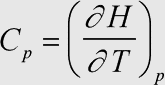
Erläuterung: Dies ist die Definition der molaren Wärmekapazität bei konstantem Druck. Sie ist ein Faktor der Zustandsfunktion der molaren Enthalpie (die unter isobaren Bedingungen der ausgetauschten Wärmemenge entspricht) und beschreibt das Maß der Änderung der molaren Enthalpie mit der Temperatur.
![]()
Herleitung: Gegenüber der Wärmekapazität bei konstantem Volumen ist die Wärmekapazität bei konstantem Druck um den Arbeitsbetrag p(VM, 2 - VM, 1) größer, den das System im isobaren Fall gegen den Außendruck verrichtet, wenn es um 1 K erwärmt wird. Weil dazu Energie nötig ist, ist die isobare Wärmekapazität größer als die isochore, da nicht die gesamte zugeführte Wärmemenge zur Temperaturerhöhung genutzt werden kann, sondern ein Teil zur Volumenarbeit benötigt wird. In Formeln stellt sich diese Tatsache wie folgt dar (der letzte Schritt nutzt die →ideale Gasgleichung):
Cp - CV = p(VM, 2 - VM, 1)K-1 = R
© Alexander Laatsch, letzte Aktualisierung am 28.11.06