| Startseite » Themen & Texte » Physikalische Chemie » Enthalpie | Zurück zur vorherigen Seite | Sitemap Impressum/Datenschutzerklärung |
Die Enthalpie entspricht dem Energiegehalt eines Systems.
Die Enthalpieänderung ist gleich der bei konstantem Druck ausgetauschten Wärmemenge.
![]() bzw.
bzw. ![]()
Erläuterung: Die Änderung der Enthalpie H (und damit entsprechend auch die Enthalpie selbst) ist definiert als diejenige Wärmemenge, die einem System bei konstantem Druck zugeführt wird. Sie entspricht deshalb der (Änderung der) →Inneren Energie plus der vom System verbrauchten Energie für die →(Volumen)arbeit gegen einen definitionsgemäß konstanten Außendruck.
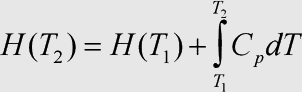
Herleitung: Die gesuchte Beziehung ist leicht zu erhalten, denn die →Wärmekapazität bei konstantem Druck beschreibt gerade die Änderung der Enthalpie mit der Temperatur (bei konstantem Druck, der für die Definition der Enthalpie Vorraussetzung ist). Man braucht diese Änderung also nur noch zur Enthalpie bei der Ausgangstemperatur addieren.
Da die Wärmekapazität ebenfalls temperaturabhängig ist, muß für genaue Berechnungen integriert werden. Innerhalb kleinerer Temperaturintervalle kann die Wärmekapazität jedoch in guter Näherung als konstant angesehen werden. Damit läßt sie sich aus dem Integral herausziehen, und es ergibt sich H(T2) = H(T1) + Cp(T2 - T1).
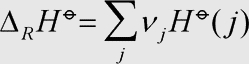
Erläuterung: Die molare Standardreaktionsenthalpie entspricht der Summe der molaren Standardenthalpien der Produkte abzüglich der Summe der molaren Standardenthalpien der Edukte, jeweils multipliziert mit dem stöchiometrischen Faktor, der in der Reaktionsgleichung vor der jeweiligen Substanz j erscheint.
Die molare Standardreaktionsenthalpie ist immer bezogen auf ein Mol Formelumsatz, d. h. der Wert ist nur dann aussagekräftig, wenn die genaue zugehörige Reaktionsgleichung bekannt ist.
Kehrt man die Richtung der Reaktion um, so ändert sich nur das Vorzeichen der Reaktionsenthalpie.
Die Formulierung dieser Tatsachen in Form der obigen Gleichung wird deutlich, wenn man in einer Reaktionsgleichung alle Edukte auf die Seite der Produkte subtrahiert. Es ergibt sich 0 → Produkte - Edukte.
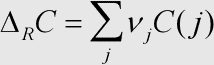
Erläuterung: Die Reaktionswärmekapazität ist eine Größe, die sich aus der Summe der molaren Wärmekapazitäten der Produkte abzüglich der Summe der molaren Wärmekapazitäten der Edukte einer chemischen Reaktion berechnen läßt (multipliziert mit dem stöchiometrischen Faktor vor dem jeweiligen Stoff j in der Reaktionsgleichung).
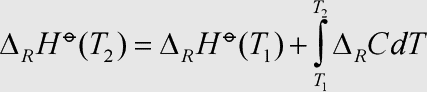
Erläuterung: Das Kirchhoff'sche Gesetz ist eine allgemeinere Formulierung der →Temperaturabhängigkeit der Enthalpie für Reaktionsenthalpien. Es ist analog aufgebaut, lediglich die molare Wärmekapazität ist durch die →Reaktionswärmekapazität ersetzt.
Auch hier ist es für kleinere Temperaturbereiche zulässig, die Wärmekapazität wie eine Konstante zu behandeln und vor das Integral zu ziehen.
© Alexander Laatsch, letzte Aktualisierung am 24.11.06