| Startseite » Themen & Texte » Physikalische Chemie » Entropie | Zurück zur vorherigen Seite | Sitemap Impressum/Datenschutzerklärung |
Die Entropie ist ein Maß für die Verteilung von Energie und Materie.
Anschaulich formuliert bedeutet eine höhere Entropie eine größere Unordnung.
Spontane Vorgänge verlaufen thermodynamisch irreversibel unter Vermehrung der Gesamtentropie.
Bei reversiblen Prozessen bleibt die Entropie konstant (→2. Hauptsatz).
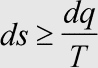
Herleitung: Die Entropieänderung ist proportional zur zugeführten Wärmemenge. Außerdem wirkt sich eine Energieerhöhung weniger stark aus, wenn schon viel Energie vorhanden ist (warmes System), umgekehrt ist der Effekt stärker, wenn zuvor weniger Energie vorhanden war (kaltes System). Es gilt ds = dq:T.
Der →2. Hauptsatz verlangt die Betrachtung von System und Umgebung, also ds = dq:T als Entropieänderung im System und ds' = dq':T als Entropieänderung in der Umgebung. Gemäß →1. Hauptsatz muß die Gesamtenergie konstant bleiben, d. h. dq' = -dq, denn der Energiebetrag dq wird nur zwischen System und Umgebung verschoben. Man erhält so
ds = dq:T und ds' = -dq:T.
Nach dem 2. Hauptsatz muß die Gesamtentropie für irreversible Vorgänge zunehmen, also ds + ds' > 0. Nach Einsetzen für ds' folgt ds - dq:T > 0. Bringt man den zweiten Summanden auf die andere Seite der Ungleichung und fügt ein Gleichheitszeichen für reversible Prozesse hinzu, so erhält man die Clausius'sche Ungleichung für die Entropieänderung im geschlossenen System.
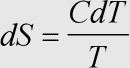 (1) bzw.
(1) bzw. 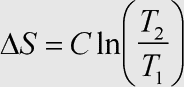 (2)
(2)
Herleitung: Da die Entropie eine Zustandsfunktion ist, genügt die Betrachtung des reversiblen Prozesses. Entsprechend der →Clausius'schen Ungleichung gilt daher ds = dq:T. Nach Einsetzen der Formel für die →ausgetauschte Wärmemenge bei Temperaturerhöhung (dq bzw. dQ) erhält man unter Beachtung der molaren Größen (1). Je nach Prozeßbedingungen (isobar, isochor) ist die entsprechende Wärmekapazität zu wählen.
Beziehung (2) folgt aus der Integration über den betrachteten Temperaturbereich, der nicht zu groß sein darf, wenn die (je nach Bedingungen isobare oder isochore) Wärmekapazität als Konstante angesehen und vor das Integral gezogen werden soll.
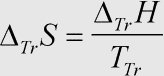
Herleitung: Bei einem Phasenübergang bei konstantem Druck ist die auftretende Wärmetönung gleich der Phasenübergangs→enthalpie (einsetzen in dS = dQ:T). Da während eines Phasenwechsels die Temperatur konstant bleibt, kann die Differentialgleichung direkt in eine Differenzengleichung umgeschrieben werden.
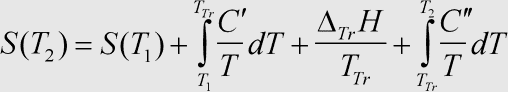
Herleitung: Während der Erwärmung eines Stoffes kann es zu einer Phasenumwandlung kommen. Da die Entropie eine Zustandsfunktion ist, kann die Erwärmung von T1 auf T2 in die Teilschritte der →Erwärmung bis zum Pasenübergang, den →Phasenübergang selbst und die Erwärmung nach dem Phasenübergang zerlegt werden. Die benötigten Formeln wurden oben erläutert und müssen nur zur absoluten Entropie bei der Ausgangstemperatur addiert werden, um die Entropie für die neue Temperatur zu erhalten.
Das Integral kann nur ausgewertet werden, wenn man die Temperaturabhängigkeit der jeweils benötigten Wärmekapazität kennt. Oft ist jedoch die Annahme der Temperaturunabhängigkeit in guter Näherung zulässig. Die Wärmekapazität kann dann vor das Integral gezogen werden. Wichtig ist jedoch die Unterscheidung der Wärmekapazität der verschwindenden und der entstehenden Phase (C' bzw. C'').
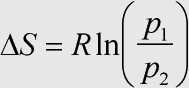
Herleitung: Da die Entropie eine Zustandsfunktion ist, genügt die Betrachtung des reversiblen Prozesses, es gilt →ds = dq:T und für den isothermen Prozeß direkt die entsprechende Differenzengleichung. Die ausgetauschte Wärmemenge ergibt sich aus der →Änderung der Inneren Energie als dq = du - dw (1). Die →Änderung der Inneren Energie bei isothermen Zustandsänderungen eines idealen Gases ist gleich 0, d. h. aus (1) wird dq = -dw (2).
Mit →dw = -pdV und (2) folgt dq = pdV (3).
Die erste Ableitung des →idealen Gasgesetzes für das Volumen nach p ist dV:dp = -nRT·p-2, bzw. umgestellt dV = -nRT·p-2dp. in (3) eingesetzt erhält man nach Kürzen dq = -nRT·p-1dp. Durch Integration gelangt man zu q = nRT·ln(p1:p2) für die ausgetauschte Wärmemenge. Die Temperatur fällt nach dem Einsetzen in die Differenzengleichung für die Entropieänderung heraus, und nach dem Teilen durch die Stoffmenge erhält man die gesuchte Beziehung.
Das Ergebnis ist auch qualitativ einleuchtend, denn durch Druckerhöhung verringert sich der Raum, der den Gasteilchen zur Verfügung steht, es gibt so weniger Möglichkeiten der Teilchenanordnung, d. h. die Entropie muß abnehmen. Dem ist in der Tat so, denn für einen höheren Druck p2 wird der Logarithmus negativ.
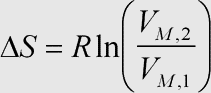
Herleitung: Die Herleitung ist bis zu Gleichung (3) identisch mit der Herleitung der →Entropieänderung mit dem Druck. Aus dem →idealen Gasgesetz ergibt sich für den Druck p = nRT·V-1. Eingesetzt in (3) integriert man über die Volumenänderung und erhält analog die Beziehung für die isotherme Volumenabhängigkeit der Entropie für ideale Gase.
Auch hier entspricht die Formel den qualitativen Überlegungen, denn für ein größeres VM, 2 haben die Gasteilchen nach der Expansion mehr Raum zur Verfügung, können sich also ungeordneter verteilen, d. h. die Entropie muß zunehmen. Der Term für die Entropieänderung wird (durch den Logarithmus) entsprechend auch nur für kleinere Endvolumen negativ.
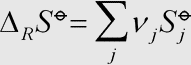
Erläuterung: Die Änderung der molaren Standardreaktionsentropie ist vollständig analog zur →Änderung der Standardreaktionsenthalpie festgelegt. Addiert (bzw. subtrahiert) werden normalerweise die absoluten Entropien der jeweiligen Stoffe nach dem →dritten Hauptsatz.
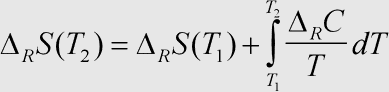
Erläuterung: Diese Beziehung zur Berechnung der Standardreaktionsentropie einer chemischen Reaktion bei verschiedenen Temperaturen ist im wesentlichen analog zum →Kirchhoff'schen Gesetz aufgebaut. Zu beachten ist wieder das Auftauchen der →Reaktionswärmekapazität.
Die Formel ist nichtmehr sinnvoll anwendbar, wenn ein oder mehr Reaktionsteilnehmer im betrachteten Temperaturbereich einen Phasensprung durchführen.
© Alexander Laatsch, letzte Aktualisierung am 24.11.06